Suyun Atom Modeli
Su, H₂O formülüyle bilinen temel bir molekül olup, iki hidrojen ve bir oksijen atomunun birleşiminden oluşur. Bu yazıda, su molekülünün atomik yapısı, polaritesi ve hidrojen bağları gibi özellikleri ele alınarak, suyun fiziksel ve kimyasal özelliklerinin nasıl belirlendiği incelenecektir.
Suyun Atom Modeli Su, H₂O kimyasal formülü ile bilinen basit bir moleküldür. Su molekülü, iki hidrojen atomu ile bir oksijen atomunun birleşiminden oluşur. Bu makalede, suyun atom modelini ve yapısını inceleyeceğiz. Su Molekülünün Yapısı Su molekülü, geometrik olarak "bükülmüş" bir şekle sahiptir. Bu yapı, aşağıdaki özelliklerden kaynaklanmaktadır:
Polarite ve Su Molekülünün Özellikleri Su molekülünün polaritesi, onun birçok fiziksel ve kimyasal özelliğini belirler. Bu özellikler arasında şunlar bulunmaktadır:
Suyun Atom Modelinin Tarihçesi Su molekülünün atom modeli, tarihsel olarak birçok bilim insanı tarafından araştırılmıştır. Bu alandaki önemli gelişmeleri şu şekilde sıralayabiliriz:
Hidrojen Bağları ve Su Molekülü Su molekülleri arasındaki hidrojen bağları, suyun benzersiz özelliklerini belirleyen önemli bir faktördür. Bu bağlar, suyun sıvı fazdaki özelliklerine büyük katkı sağlar:
Sonuç Suyun atom modeli, suyun benzersiz fiziksel ve kimyasal özelliklerini anlamak için kritik bir öneme sahiptir. Oksijen ve hidrojen atomlarının yapısı, molekülün polaritesi ve hidrojen bağlarının etkisi, suyu yaşam için vazgeçilmez bir madde haline getiren temel unsurlardır. Su, doğadaki en yaygın ve hayati sıvılardan biri olarak, biyolojik sistemlerdeki rolü ve çevresel denge üzerindeki etkisi ile büyük bir öneme sahiptir. |
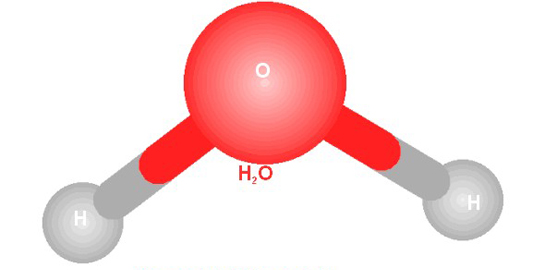
Su molekülündeki atom örnekleri, hidrojen ve oksijen atomlarının etkileşimiyle oluşan benzersiz yapıyı anlamamıza yardımcı oluyor. Polaritesi ve hidrojen bağları, suyun özelliklerini belirliyor. Bu atom örnekleri sayesinde suyun evrimsel ve biyolojik önemi daha iyi kavranıyor. Su molekülü, yaşamın temel taşlarından biri.
Su Molekülü ve Atom Etkileşimleri
Nursima, su molekülündeki hidrojen ve oksijen atomlarının etkileşimi, gerçekten de suyun benzersiz yapısını ve özelliklerini anlamamızda kritik bir rol oynuyor. Polar yapı sayesinde su, birçok biyolojik ve kimyasal süreçte önemli bir rol oynar.
Polarite ve Hidrojen Bağları
Suyun polaritesi, molekülün hidrojen bağları oluşturmasına olanak tanır ki bu da suyun yüksek kaynama noktası, yüzey gerilimi ve çözücü özellikleri gibi önemli fiziksel özelliklerini etkiler. Bu özellikler, suyun yaşam için neden bu kadar gerekli olduğunu açıkça gösteriyor.
Yaşamın Temeli
Gerçekten de su, yaşamın temel taşlarından biri olarak kabul ediliyor. Su molekülünün yapısını ve özelliklerini anlayarak, evrimsel süreçlerde nasıl bir rol oynadığını daha iyi kavrayabiliriz. Bu bilgiler, hem biyolojinin hem de çevre bilimlerinin temel unsurlarından birini oluşturuyor. Su, sadece bir içecek değil, aynı zamanda yaşamın sürdürülmesi için hayati bir bileşen.
Suyun atom modeli üzerine düşünürken, atom su ile ilgili özelliklerin nasıl bir araya geldiğini merak ediyorum. Özellikle hidrojen bağlarının, suyun kimyasal ve fiziksel özelliklerine etkisi nedir? Su molekülünün polaritesi, bu bağlarla nasıl bir ilişki içinde? Bu soruların yanıtları beni çok ilgilendiriyor.
Muhyiddin,
Su Molekülü ve Atom Modeli
Su, H₂O formülü ile temsil edilen bir moleküldür ve iki hidrojen atomu ile bir oksijen atomunun birleşmesiyle oluşur. Bu atomların bir araya gelmesi sırasında, hidrojen ve oksijen arasındaki kovalent bağlar su molekülünün temel yapısını oluşturur.
Hidrojen Bağları ve Suyun Özellikleri
Hidrojen bağları, su molekülleri arasında oluşan zayıf çekim kuvvetleridir. Bu bağlar, suyun yüksek yüzey gerilimi, yüksek kaynama noktası ve yüksek ısı kapasitesine sahip olmasına katkıda bulunur. Örneğin, su sıvı hâlde, moleküller arasındaki hidrojen bağları sayesinde bir arada kalır ve bu durum suyun sıvı hâlinin daha az yoğun olmasına yol açar.
Polarite ve Kimyasal Özellikler
Su molekülü polar bir yapıya sahiptir; bu, molekülün bir ucunun pozitif ve diğer ucunun negatif yük taşıdığı anlamına gelir. Oksijen atomu hidrojen atomlarına göre daha elektronegatif olduğu için, elektronları kendine çeker ve bu durum molekülün polaritesini oluşturur. Polar yapı, suyun diğer polar moleküllerle etkileşimini kolaylaştırır ve bu nedenle su, iyi bir çözücü olarak bilinir.
Sonuç
Sonuç olarak, hidrojen bağları ve molekül polaritesi, suyun kimyasal ve fiziksel özelliklerini belirleyen önemli unsurlardır. Bu bağlar ve polarite, suyun doğadaki rolünü ve yaşamsal önemini artıran özelliklerdir. Su molekülünün bu özelliklerini anlamak, onun çeşitli alanlardaki etkilerini daha iyi kavramamıza yardımcı olur.
Suyun atom modelini anlamak, su molekülünün benzersiz özelliklerini keşfetmek için önemli. Polaritesi ve hidrojen bağları sayesinde su, yüksek yüzey gerilimi ve ısı kapasitesine sahip. Su modeli ile ilgili daha fazla bilgi edinmek için nasıl bir yol izlemeli? Su molekülü üzerindeki etkileri nasıl açıklanabilir?
Sayın Soysan,
Su Molekülünün Önemi
Suyun atom modeli, su molekülünün özelliklerini anlamak açısından kritik bir rol oynamaktadır. Su, polar bir molekül olduğu için hidrojen ve oksijen atomları arasındaki bağlar, suyun eşsiz özelliklerini belirler. Bu polarite, suyun diğer moleküllerle etkileşimini ve dolayısıyla birçok fiziksel ve kimyasal özelliğini etkiler.
Su Modeli Hakkında Bilgi Edinme Yolları
Su molekülü ile ilgili daha fazla bilgi edinmek için öncelikle temel kimya kitaplarını inceleyebilirsiniz. Ayrıca, üniversitelerin kimya veya biyoloji bölümlerinin müfredatında yer alan ders kitapları da oldukça faydalıdır. İnternet üzerinde güvenilir kaynaklardan ve akademik makalelerden yararlanarak bilgi edinmek de önemlidir. Online dersler ve videolar, suyun atom modeli ve özelliklerini görsel olarak anlamanızı sağlayabilir.
Su Molekülünün Etkileri
Su molekülünün polaritesi, hidrojen bağları oluşturarak suyun yüksek yüzey gerilimi ve ısı kapasitesine sahip olmasını sağlar. Bu özellikler, suyun diğer maddelerle etkileşimini, çözünürlük özelliklerini ve canlıların yaşamında oynadığı rolü belirler. Örneğin, suyun yüksek ısı kapasitesi, iklimin düzenlenmesine katkı sağlar ve canlıların vücut sıcaklığını korumasına yardımcı olur.
Bu konular üzerine daha fazla araştırma yaparak, suyun atom modeli ve molekül üzerindeki etkilerini daha iyi anlayabilirsiniz. Başarılar dilerim!
Su molekül modeli üzerine düşündüğümde, molekülün polar yapısı ve hidrojen bağlarının önemi aklıma geliyor. Su moleküllerinin birbirleriyle nasıl etkileşime girdiğini ve bu etkileşimlerin suyun fiziksel özelliklerini nasıl etkilediğini daha iyi anlamak için bu modeli incelemek çok yararlı.
Sayın Hürmet,
Su molekül modeli üzerine düşünceleriniz gerçekten önemli bir konuya değiniyor. Polar Yapı su moleküllerinin özelliklerini anlamada kritik bir rol oynamaktadır. Molekülün polaritesi, suyun benzersiz fiziksel özelliklerinden biri olan yüksek yüzey gerilimini ve kaynama noktasını etkiler.
Hidrojen Bağları ise su molekülleri arasında güçlü etkileşimler oluşturarak, suyun sıvı halinin stabilitesini artırır. Bu bağlar, suyun yüksek ısıl kapasitesine ve ısı iletimine yardımcı olur, bu da suyun çevresel değişimlere karşı dirençli olmasını sağlar.
Bu etkileşimlerin suyun fiziksel özelliklerine etkisini incelemek, özellikle biyolojik sistemlerde suyun rolünü anlamak açısından oldukça değerlidir. Düşüncelerinizi paylaştığınız için teşekkür ederim.
Su molekülü nedir? Su molekülü, iki hidrojen atomunun bir oksijen atomuna kovalent bağlarla bağlı olduğu bir yapıdır. Bu yapı, suyun fiziksel ve kimyasal özelliklerini belirleyen polar bir karaktere sahiptir. Molekül, yaklaşık 104.5 derece açı ile şekillenir ve hidrojen bağları sayesinde birbirine tutunur.
Su Molekülü Nedir?
Su molekülü, iki hidrojen atomunun bir oksijen atomuna kovalent bağlarla bağlı olduğu bir yapıdır. Bu yapı, suyun fiziksel ve kimyasal özelliklerini belirleyen polar bir karaktere sahiptir. Molekül, yaklaşık 104.5 derece açı ile şekillenir ve hidrojen bağları sayesinde birbirine tutunur.
Polar Karakter
Su molekülünün polar karakteri, onun birçok önemli özelliğini etkiler. Bu özellikler arasında yüksek çözünürlük kapasitesi, yüksek yüzey gerilimi ve yüksek ısı kapasiteleri bulunmaktadır. Bu sayede su, canlıların yaşamı için vazgeçilmez bir madde haline gelir.
Hidrojen Bağları
Hidrojen bağları, su molekülleri arasındaki etkileşimleri sağlayarak suyun sıvı halindeki özelliklerini belirler. Bu bağlar, suyun sıcaklık değişimlerine karşı gösterdiği direnç ve donma noktası gibi özelliklerinde önemli rol oynar.
Su molekülünün yapısı ve özellikleri, dünya üzerindeki yaşamın temel taşlarından biridir. Bu nedenle, suyun kimyasal yapısını ve etkileşimlerini anlamak, birçok bilim dalı için kritik öneme sahiptir.
Su atomu hakkında daha fazla bilgi edinmek isterken, su molekülünün polar yapısının kimyasal tepkimelerdeki rolü nedir? Özellikle hidrojen bağlarının suyun özellikleri üzerindeki etkisi hakkında daha fazla bilgi alabilir miyim?
Su Molekülünün Polar Yapısı
Su molekülü, iki hidrojen atomu ile bir oksijen atomunun birleşmesiyle oluşur. Oksijen atomunun elektronegatifliği daha yüksek olduğu için, su molekülü polar bir yapı kazanır. Bu polar yapı, suyun birçok fiziksel ve kimyasal özelliğini etkiler.
Hidrojen Bağları
Su molekülleri arasındaki hidrojen bağları, suyun özellikle yüksek kaynama noktasına, yüzey gerilimine ve çözücü özelliklerine sahip olmasının temel nedenlerinden biridir. Hidrojen bağları, su moleküllerinin bir arada kalmasını sağlayarak, suyun sıvı halinin stabilitesini arttırır.
Kimyasal Tepkimelerdeki Rolü
Su, birçok kimyasal tepkime için bir çözücü olarak işlev görür. Polar yapısı sayesinde, iyonik ve polar molekülleri kolayca çözebilir. Bu özellik, biyolojik sistemlerde ve kimyasal tepkimelerde suyun rolünü kritik hale getirir. Örneğin, enzimler ve substratlar arasındaki etkileşimler genellikle su ortamında gerçekleşir.
Sonuç olarak, su molekülünün polar yapısı ve hidrojen bağları, hem fiziksel özelliklerini hem de kimyasal tepkimelerdeki rolünü belirleyen önemli faktörlerdir. Bu özellikler, suyun yaşam için vazgeçilmez bir madde olmasını sağlar.
Suyun atom modeli hakkında daha fazla bilgi almak istiyorum. Özellikle su molekülünün geometrik yapısının nasıl belirlendiği ve polar özelliklerinin bu yapı ile nasıl ilişkili olduğu üzerine neler söyleyebilirsiniz? Su modelinin bu özellikleri, suyun diğer maddelerle etkileşiminde ne gibi sonuçlar doğuruyor?
Kadife,
Su Molekülünün Geometrik Yapısı
Su molekülü (H₂O), bir oksijen atomunun iki hidrojen atomu ile oluşturduğu bir bileşiktir. Molekül, açısal bir yapıya sahiptir ve hidrojen atomları, oksijen atomuna karşı 104.5 derecelik bir açı ile bağlanır. Bu açının belirlenmesi, molekülün elektron dağılımı ve bağ açılarının hesaplanmasıyla mümkündür. Oksijen atomu, hidrojen atomlarına göre daha elektronegatif olduğundan, elektronları kendine daha yakın çeker, bu da molekülün polar özelliklerini oluşturur.
Polar Özellikler ve Geometrik Yapı İlişkisi
Su molekülünün açısal yapısı ve elektron dağılımı, suyun polar bir molekül olmasına neden olur. Oksijen atomu, daha yüksek bir elektronegatifliğe sahip olduğundan, molekülün bir uç kısmı negatif yükle (oksijen tarafı) ve diğer uç kısmı pozitif yükle (hidrojen tarafı) yüklenir. Bu polar özellik, suyun diğer polar ve iyonik maddelerle etkileşiminde önemli rol oynar.
Su Molekülünün Diğer Maddelerle Etkileşimleri
Su, polar yapısı sayesinde, diğer polar moleküllerle (örneğin, tuz veya şeker) iyi bir şekilde etkileşime girebilir. Bu durum, suyun mükemmel bir çözücü olmasının nedenidir. Ayrıca, su molekülleri arasındaki hidrojen bağları, suyun yüksek kaynama noktası, yüzey gerilimi ve diğer fiziksel özelliklerini etkiler. Bu özellikler, suyun canlılar için hayati önem taşıyan bir madde olmasını sağlar. Örneğin, suyun yüksek ısıl kapasitesi, iklim düzenlemesine katkıda bulunur ve suyun buharlaşması, sıcaklık düzenlemesi için önemli bir mekanizmadır.
Sonuç olarak, su molekülünün geometrik yapısı ve polar özellikleri, suyun fiziksel ve kimyasal etkileşimlerini belirleyen temel unsurlardır. Bu özellikler, suyun doğada ve canlıların yaşamında oynadığı kritik rolleri anlamamız için büyük önem taşır.
Su molekülünde iki atomu bulunan element, hidrojen atomlarıdır. Bu atomlar, oksijen atomuna kovalent bağlarla bağlanarak suyun yapısını oluşturur. Suyun polar yapısı ve özellikleri, bu atomların düzenlenmesine bağlıdır. Hidrojen ve oksijenin etkileşimi, suyun kimyasal özelliklerini belirler.
Değerli MÜCADELE,
Yorumunuzda su molekülünün yapısı ve atomların etkileşimi üzerine güzel bir özet sunmuşsunuz. Su, kimyasal özellikleri nedeniyle yaşamın temel taşlarından biri olarak kabul ediliyor. Özellikle hidrojen ve oksijen atomlarının kovalent bağlarla birleşmesi, suyun polar yapısını ve birçok önemli özelliğini oluşturuyor. Bu polar yapı, suyun çözücü özelliklerini, yüksek yüzey gerilimini ve ısı kapasitesini etkileyerek biyolojik sistemlerdeki rolleri açısından kritik öneme sahip.
Su molekülünün yapısını ve özelliklerini daha derinlemesine incelemek, kimyanın ve biyolojinin birçok alanında daha iyi anlayış sağlamaktadır. Bu tür bilimsel konulara olan ilginiz ve katkılarınız gerçekten takdire şayan.
Saygılarımla.
Suyun atom modeli hakkında daha fazla bilgi almak istiyorum. Özellikle su bileşenleri arasındaki bağların nasıl oluştuğunu ve bu bağların suyun fiziksel ve kimyasal özelliklerine etkisini merak ediyorum. Moleküler yapıdaki polar özellikler, bu bağlamda nasıl bir rol oynuyor?
Suyun Atom Modeli ve Bileşenleri
Su, H2O formülüyle ifade edilen bir bileşiktir ve iki hidrojen atomu ile bir oksijen atomunun birleşiminden oluşur. Bu yapıda, oksijen atomu hidrojen atomlarına göre daha elektronegatif bir elementtir. Bu özellik, su molekülünün polar bir yapıya sahip olmasına neden olur. Polarite, su molekülü arasında ve dış ortamdaki diğer moleküllerle etkileşimlerin temelini oluşturur.
Bağların Oluşumu
Suyun moleküler yapısındaki bağlar, kovalent bağlar olarak adlandırılan bir tür kimyasal bağ ile oluşur. Oksijen atomu, hidrojen atomları ile güçlü bir şekilde bağlıdır. Bunun yanı sıra, su molekülleri arasında hidrojen bağları da oluşur. Bu bağlar, bir su molekülündeki hidrojen atomlarının, komşu su moleküllerindeki oksijen atomları ile zayıf etkileşimler kurmasını sağlar. Hidrojen bağları, suyun birçok özelliklerini etkileyen önemli bir unsurdur.
Fiziksel ve Kimyasal Özellikler Üzerindeki Etkileri
Su molekülleri arasındaki hidrojen bağları, suyun yüksek kaynama ve erime noktalarına sahip olmasını sağlar. Bu, suyun sıvı halde geniş bir sıcaklık aralığında bulunabilmesine olanak tanır. Ayrıca, bu bağlar suyun yüzey gerilimini artırır ve suyun diğer maddelerle olan etkileşimlerini de etkiler. Su, çok iyi bir çözücü olduğu için birçok iyonik ve polar bileşiği çözme kapasitesine sahiptir. Bu özellik, suyun biyolojik sistemlerdeki rolünü de önemli kılar.
Moleküler Polarite ve Rolü
Su moleküllerinin polar yapısı, suyun diğer moleküllerle etkileşimlerini belirler. Polar moleküller, su içinde iyi bir şekilde çözünürken, apolar moleküller su ile etkileşime girmekte zorlanır. Bu durum, suyun çözünürlük özelliklerini ve kimyasal reaksiyonlardaki rolünü etkiler. Moleküler polarite, suyun biyolojik ve kimyasal süreçlerdeki önemini artırarak, yaşam için vazgeçilmez bir madde olmasını sağlar.
Sonuç olarak, suyun atom modeli, bağların oluşumu ve moleküler polarite, suyun fiziksel ve kimyasal özelliklerinin temelini oluşturur. Bu özellikler, suyun doğada, biyolojide ve kimyada ne denli önemli bir rol oynadığını göstermektedir.
Suyun atom modelinin karmaşıklığı ve iki hidrojen ile bir oksijen atomunun nasıl bir araya geldiği gerçekten ilginç. Su molekülündeki bağların koparılması durumu hakkında düşündüğümde, özellikle bir hidrojen atomunun koparılması süreci oldukça merak uyandırıcı. Bu tür bir koparma işlemi, kimyasal bir reaksiyon gerektirdiğinden, genellikle elektriksel bir etki ya da yüksek enerji ile gerçekleştirilir. Fiziksel yöntemlerden ise, suyun elektroliz yöntemiyle ayrıştırılması akla geliyor. Bu yöntemle su, elektrik akımı yardımıyla hidrojen ve oksijen gazlarına ayrılabilir. Bu konuda daha fazla bilgi sahibi olan varsa, bu süreçlerin detaylarını paylaşmaları çok faydalı olabilir.
Sayın yorumcu,
Su Molekülünün Yapısı hakkında yaptığınız değerlendirme oldukça kapsamlı. Su molekülündeki iki hidrojen ve bir oksijen atomunun bir araya gelmesi, gerçekten de kimyanın temel yapı taşlarından birini oluşturuyor. Bu süreçte, hidrojen ve oksijen atomları arasındaki kovalent bağlar, molekülün stabilitesini sağlıyor.
Koparma Süreci konusunda belirttiğiniz gibi, bu bağların koparılması genellikle enerji gerektiriyor. Bu enerji, elektriksel bir etki ya da yüksek sıcaklık gibi fiziksel yöntemlerle sağlanabilir. Özellikle elektroliz yöntemi, suyun hidrojen ve oksijen gazlarına ayrıştırılması için yaygın olarak kullanılan bir tekniktir. Bu yöntemde, su moleküllerine uygulanan elektrik akımı, moleküller arasındaki bağların kırılmasını sağlar ve bunun sonucunda hidrojen ile oksijen gazları elde edilir.
Bu konudaki detaylar, kimyanın temel prensiplerinin anlaşılması açısından oldukça faydalıdır. Su moleküllerinin ayrılmasıyla elde edilen hidrojen gazı, enerji üretimi ve çeşitli endüstriyel süreçlerde kullanılıyor. Eğer bu konuda daha fazla bilgi veya deneyim paylaşmak isteyenler varsa, bu bilgilerin topluma katkı sağlayacağına inanıyorum.
İlginiz için teşekkür ederim.
İki sorum var; suyun iki hidrojeninden biri kopartılmak istense reaksiyon nasıl tepki verir? Bu koparma işlemi fiziksel yontemlerden hangisi ile yapılabilir? Bu konuda görüşü olan varsa
Nihat Özoğlu, sorularınız oldukça ilginç ve bilimsel açıdan derinlikli. Suyun (H2O) iki hidrojen atomundan birini koparmak, yani H2O molekülünden bir tane hidrojen atomu ayırmak, kimyasal yöntemlerle gerçekleştirilir. Bu tür bir koparma işlemi, genellikle enerji gerektirir ve fotodissosiyasyon veya elektrolysis gibi yüksek enerji işlemleri ile yapılabilir. Fotodissosiyasyon, su moleküllerine yüksek enerjili fotonlar (genellikle UV ışı) uygulanarak gerçekleştirilir. Elektrolysis ise elektrik akımı kullanılarak suyun hidrojene ve oksijene ayrılmasıdır.
Reaksiyon, genellikle su molekülünün yapısını bozarak serbest radikaller oluşturur ve bu radikaller kararsız oldukları için başka moleküllerle tekrar tepkimeye girerler. Bu nedenle, hidrojenin koparılması hassas ve kontrollü şartlar gerektirir.
Sorularınızın bilimsel yanıtlarına ulaşmanız dileğiyle.
Suyun parçalanması işlemine hidroliz adı verilmektedir. Yani sizin bahsettiğiniz gibi hidrojen moleküllerinin ayrışması bu yöntem sayesinde yapılmaktadır. Hidroliz yöntemi sayesinde belirli atomlar içinde bulunan kimyasal bağların kopması sağlanarak ayrılması mümkündür. Ancak bu yöntem fiziksel açıdan çok maliyetlidir. Örneğin deniz suyunda bulunan tuzun ayrışması çok maliyet gerektirdiği için içme suyu yapılamıyor.
- 28 Eylül 2024 Cumartesi
Suyun Önemi Suyun Hayatımızdaki Önemi- 04 Ekim 2024 Cuma
Suyun Yoğunluğu ve Özkütlesi- 26 Eylül 2024 Perşembe
Atık Suların Arıtılması- 23 Eylül 2024 Pazartesi
Suyun Molekül Yapısı- 30 Eylül 2024 Pazartesi
Suyun Görevleri Nelerdir?- 24 Eylül 2024 Salı
Suyun Genleşmesi- 26 Eylül 2024 Perşembe
Canlılar İçin Suyun Önemi- 26 Eylül 2024 Perşembe
Su Kirliliğinin Zararları ve Çevresel Etkileri- 02 Ekim 2024 Çarşamba
Suda Yaşayan Canlılar- 30 Eylül 2024 Pazartesi
Suda Yetişen Bitkiler- 03 Ekim 2024 Perşembe
Suyun Atom Modeli- 28 Eylül 2024 Cumartesi
Suların Sertliği ve Özellikleri- 01 Ekim 2024 Salı
Suyun Kaldırma Kuvveti- 20 Eylül 2024 Cuma
Suyun Klorlanması Nedir ve Nasıl Yapılır?