Amonyak ve su arasındaki tepkime nasıl gerçekleşir?
Amonyak ve suyun kimyasal etkileşimi, asit-baz tepkimelerinin temel prensiplerini gösteren dengeli bir süreçtir. Bu tepkime, amonyum iyonları ve hidroksit iyonları oluşturarak temizlikten tarıma kadar çeşitli uygulamalarda kullanılan zayıf bazik çözeltilerin oluşumunu sağlar.
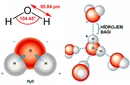
Amonyak ve Su Arasındaki Tepkimeye Genel Bakış Amonyak (NH₃) ve su (H₂O) arasındaki tepkime, bir asit-baz tepkimesi olarak sınıflandırılır. Bu tepkimede amonyak, su moleküllerinden bir proton (H⁺ iyonu) alarak baz gibi davranırken, su ise proton vererek asit gibi davranır. Bu süreç sonucunda amonyum iyonu (NH₄⁺) ve hidroksit iyonu (OH⁻) oluşur. Tepkime, dengede olduğu için tam olarak ilerlemez ve hem reaktanlar hem de ürünler bir arada bulunur. Tepkimenin Kimyasal Denklemi Tepkimenin genel denklemi şu şekildedir: NH₃ + H₂O ⇌ NH₄⁺ + OH⁻ Bu denklem, tepkimenin dengede olduğunu ve her iki yönde de gerçekleşebileceğini gösterir. Amonyak çözeltileri hafif bazik özellik gösterir çünkü hidroksit iyonları (OH⁻) oluşur. Tepkimenin Mekanizması ve Aşamaları Tepkime, aşağıdaki adımlarla gerçekleşir:
Bu süreç, Lewis asit-baz teorisine göre de açıklanabilir: Amonyak, suya bir çift elektron vererek koordine kovalent bağ oluşturur. Tepkimenin Özellikleri ve Önemi Bu tepkimenin bazı önemli özellikleri şunlardır:
Uygulama Alanları Amonyak ve su tepkimesi, aşağıdaki alanlarda pratik öneme sahiptir:
Sonuç Amonyak ve su arasındaki tepkime, basit ama önemli bir asit-baz tepkimesidir. Bu tepkime, amonyak çözeltilerinin bazik doğasını açıklar ve çeşitli endüstriyel ve evsel uygulamalarda kullanılır. Dengeli bir tepkime olması, çözeltide hem amonyak hem de iyonların bir arada bulunmasına olanak tanır. |