Amonyak ve su tepkimesi nasıl gerçekleşir?
Amonyak ve suyun kimyasal dansı, zayıf bir bazın suyla etkileşiminin tipik bir örneğini sergiler. Bu tersinir tepkime, amonyum ve hidroksit iyonlarının oluşumuyla sonuçlanarak hafif bazik bir çözelti meydana getirir. Günlük temizlik ürünlerinden endüstriyel uygulamalara kadar geniş bir kullanım alanı bulunan bu tepkime, asit-baz kimyasının temel prensiplerini anlamak için mükemmel bir model oluşturur.
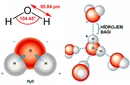
Amonyak ve Su Tepkimesi Amonyak (NH3) ve su (H2O) arasındaki tepkime, bir asit-baz tepkimesi olarak sınıflandırılır. Bu tepkimede amonyak, su ile reaksiyona girerek amonyum iyonu (NH4+) ve hidroksit iyonu (OH-) oluşturur. Tepkime, dengede olan ve tersinir bir süreçtir. Tepkime Denklemi Genel tepkime denklemi şu şekildedir: NH3+ H2O ⇌ NH4++ OH- Bu denklem, amonyağın su içinde çözündüğünde zayıf bir baz gibi davrandığını gösterir. Tepkime, suyun protonunu (H+) amonyağa aktarmasıyla gerçekleşir. Tepkime Mekanizması Amonyak ve su tepkimesi şu adımlarla açıklanabilir:
Tepkime, dengede olduğundan, hem ileri hem de geri yönde devam eder. Bu nedenle, çözeltide hem NH3, hem NH4+, hem de OH-iyonları bulunur. Tepkimenin Özellikleri
Uygulama ve Önemi Amonyak ve su tepkimesi, günlük hayatta ve endüstride yaygın olarak kullanılır. Örneğin, ev temizlik ürünlerinde amonyak çözeltileri, bazik yapıları sayesinde yağ ve kirleri çözmek için tercih edilir. Ayrıca, tarımda gübre üretiminde ve kimya endüstrisinde çeşitli sentezlerde bu tepkimenin ürünleri kullanılır. Sonuç olarak, amonyak ve su tepkimesi, basit ama önemli bir kimyasal süreçtir ve asit-baz kimyasının temel prensiplerini gösterir. |