Asit ve su tepkimesi nasıl gerçekleşir ve ne sonuçlar doğurur?
Asitlerin suyla tepkimesi, kimyasal süreçlerin temelini oluşturan önemli bir olgudur. Bu etkileşim, iyonlaşma mekanizmasıyla çözeltilerin asidik özellik kazanmasına yol açar ve hem laboratuvar uygulamalarında hem de endüstriyel süreçlerde kritik rol oynar. Tepkimenin ekzotermik doğası, pH değişimleri ve ortaya çıkan kimyasal reaktivite, bu sürecin anlaşılmasını gerekli kılar.
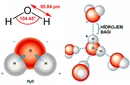
Asit ve Su Tepkimesinin Temel Prensibi Asit ve su tepkimesi, genellikle asidin su ile seyreltilmesi sürecini ifade eder. Bu tepkime, asidin suya eklenmesiyle gerçekleşir ve ekzotermik (ısı veren) bir özellik gösterir. Tepkime sırasında asit molekülleri (örneğin, HCl veya H₂SO₄) suda çözünerek iyonlarına ayrışır. Örneğin, hidroklorik asit (HCl) suda H⁺ ve Cl⁻ iyonlarına ayrılır. Bu süreç, asidin proton (H⁺) verme özelliği nedeniyle gerçekleşir ve su, bu protonları kabul ederek hidronyum iyonları (H₃O⁺) oluşturur. Tepkime, asidin konsantrasyonuna bağlı olarak şiddetli olabilir ve her zaman asidi suya eklemek güvenlik açısından kritik önem taşır; tersi durumda (suyu aside eklemek) tehlikeli sıçramalara neden olabilir. Tepkimenin Kimyasal Mekanizması Asit ve su tepkimesi, basit bir çözünme veya iyonlaşma süreci olarak görülebilir. Genel olarak, bir asit (HA) su (H₂O) ile tepkimeye girdiğinde aşağıdaki denklemle ifade edilir:
Burada, HA asidi temsil eder (örneğin, asetik asit için CH₃COOH), H₃O⁺ hidronyum iyonu, A⁻ ise asidin eşlenik bazıdır. Tepkime, suyun polar yapısı sayesinde asit moleküllerinin ayrışmasını kolaylaştırır. Özellikle kuvvetli asitler (HCl, HNO₃ gibi) tamamen iyonlaşırken, zayıf asitler (CH₃COOH gibi) kısmen iyonlaşır. Bu iyonlaşma, çözeltinin pH'ını düşürerek asidik özellik kazanmasına yol açar. Tepkimenin Fiziksel ve Kimyasal Sonuçları Asit ve su tepkimesinin sonuçları, hem fiziksel hem de kimyasal değişimlerle kendini gösterir. Başlıca sonuçlar şunlardır:
Pratik Uygulamalar ve Önlemler Asit ve su tepkimesi, günlük hayatta ve endüstride önemli rol oynar. Örneğin, pil asitlerinin seyreltilmesi, temizlik ürünlerinin hazırlanması veya kimyasal sentezlerde kullanılır. Ancak, bu tepkime sırasında dikkat edilmesi gereken noktalar vardır:
Sonuç olarak, asit ve su tepkimesi basit görünse de, kimyasal prensipleri ve pratik sonuçlarıyla önemli bir konudur. Doğru uygulandığında birçok fayda sağlarken, yanlış kullanımı tehlikeli durumlara yol açabilir. |